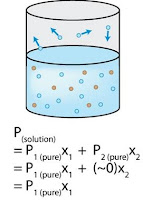
ความดันไอที่ลดต่ำลง เป็นสมบัติคอลิเกตีฟของสารละลาย จากกฎของราอูลต์
P1 = X1P1o
ΔP = P1o - P1
= P1o - X1P1o (แทนค่า P1 ตามกฎของราอูลต์)
= P1o (1-X1)
1. ความดันไอที่ต่ำลง
น้ำหนักโมเลกุลของน้ำตาลกลูโคส = (12.0 x 6 + 1.0 x 12 + 16.0 x 6) = 180g/mol
จำนวนโมลของน้ำตาล = 68/180 = 0.38 >> n2
น้ำหนักโมเลกุลของน้ำ = 18 g/mol
จำนวนโมลของน้ำ = 1000/18 = 55.56 >> n1
ความดันไอที่ลดต่ำลง = X2 P01 = 0.38 / (0.38+55.56) x 28.35 torr= 0.19 torr #
2. ความดันไอเหนือสารละลาย
ความดันไอที่ลดต่ำลง = P01 - P 1
0.19 torr = 28.35 torr - P1
P1 = 28.35 torr - 0.19 torr
ดังนั้น ความดันไอเหนือสารละลาย เท่ากับ 28.16 torr

ไม่มีความคิดเห็น:
แสดงความคิดเห็น